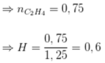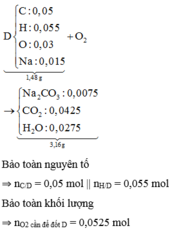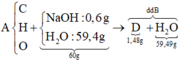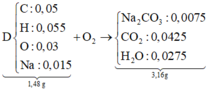Phân tích 0,157 gam chất hữu cơ A (chứa vòng benzen) chứa C, H, Br; thu được 0,005 mol H, 0,001 mol Br, còn lại là cacbon, biết MA < 200. Từ C2H5OH và các chất vô cơ không chứa cacbon, điều kiện phản ứng có đủ, cần ít nhất bao nhiêu phương trình phản ứng để điều chế A ?
A. 7
B. 6
C. 4
D. 5